哈佛医学院最新Cell封面文章:膜电位是细胞感知并响应机械压力的核心介质
在细胞生物学领域,机械力如何影响细胞生长、死亡与分化的具体机制长期以来仍不明确。与此同时,静息膜电位的变化在发育、分化、再生及癌症等多种生理与病理过程中被广泛观察到,但其上游调控机制与功能意义尚不清晰。2025年12月2日,一项由哈佛医学院等机构的研究团队在cell上发表的研究首次揭示:膜电位是细胞响应机械压力的核心介质。该研究通过实验与建模相结合的方式,证明机械压力可改变细胞生物质密度,进而直接调节膜电位;膜电位随后通过调控 Hippo 和 MAPK 等信号通路,影响细胞增殖、凋亡与组织稳态。这一发现不仅为机械信号转导提供了全新视角,也建立了膜电位在组织修复、发育调控及肿瘤发生中的关键桥梁。
核心发现
- 机械压力 → 生物质密度 → 膜电位 → 细胞行为
- 机械压力作用于细胞,改变其生物质密度(单位体积内的蛋白质、RNA等大分子含量)。
- 生物质密度的变化直接影响膜电位:密度增加导致超极化,密度降低导致去极化。
- 膜电位进而调控细胞生长、增殖、凋亡和迁移,影响组织密度和稳态。
- 生物质密度不是恒定的
- 传统观点认为生物质密度恒定,但研究发现它在生理过程中(如伤口愈合、上皮成熟)会发生显著变化。
- 膜电位是组织密度的传感器和调节器
- 高组织密度 → 高生物质密度 → 超极化 → 抑制增殖。
- 低组织密度 → 低生物质密度 → 去极化 → 促进增殖和迁移。
- 机械-电-渗透模型
- 提出了一个基于物理原理的模型,解释了机械压力如何通过离子和生物质密度的平衡影响膜电位。
- 膜电位调控Hippo和MAPK信号通路
- 去极化促进YAP入核(促进生长),超极化促进YAP出核(抑制生长)。
- 膜电位还通过调控JNK和p38等MAPK通路影响细胞行为。
- 伤口愈合中的去极化波
- 伤口边缘的细胞因拉伸而生物质密度降低,引发去极化波,促进深层细胞的增殖和迁移,加速愈合。
- 在体内模型中的验证
- 在非洲爪蟾尾部和海葵再生模型中,同样观察到伤口边缘的生物质密度下降和去极化现象。
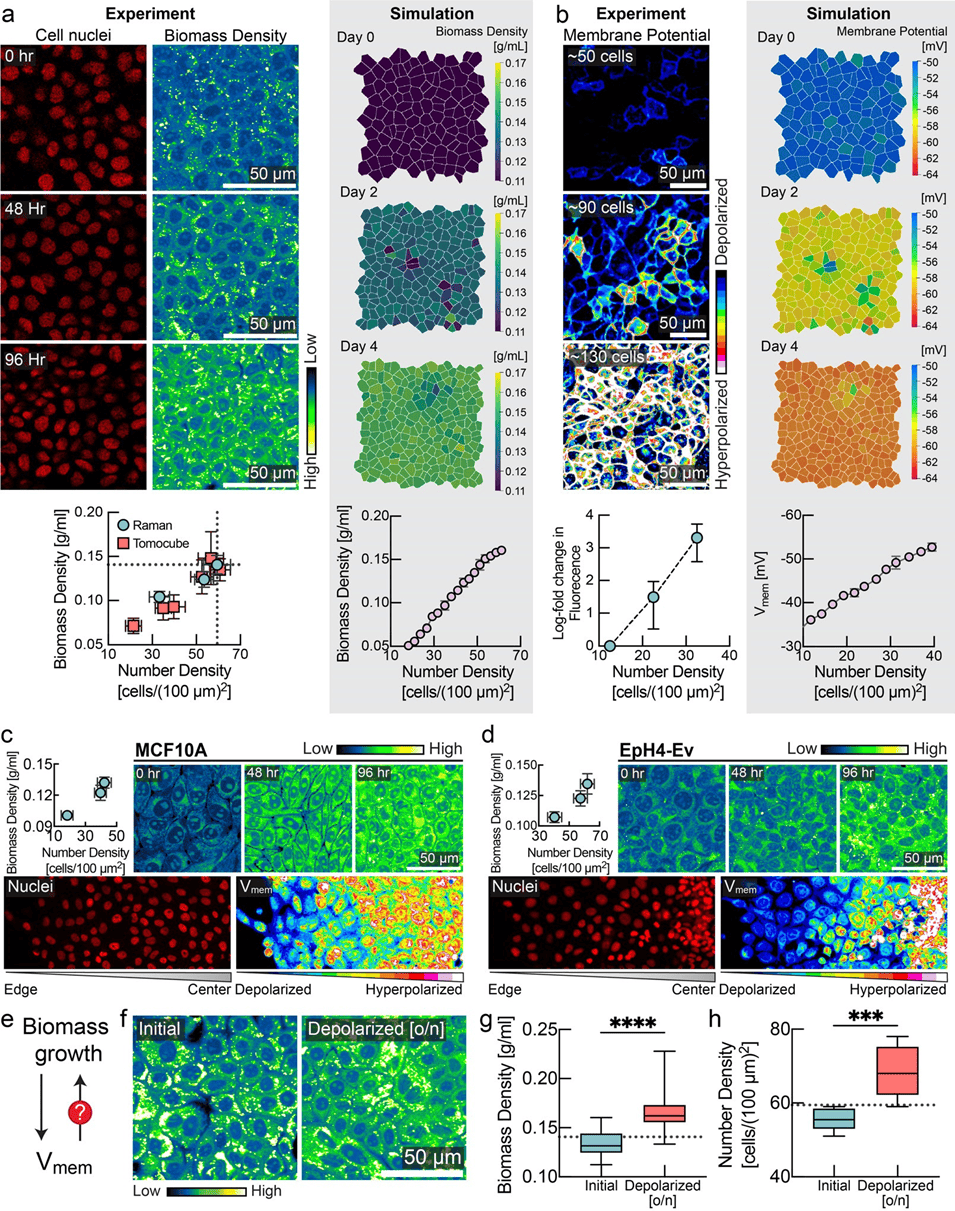
图 1:膜电位是组织密度的传感器和调节器。a、生物量密度随细胞密度的增加而上升。在对 MDCK细胞进行汇合处理后,连续4天对其进行了成像,期间细胞数量密度逐渐增加。左图显示细胞核数量与细胞生物量密度(单位:个通过标准化激发拉曼光谱技术(NORI)进行测量,得到每毫升中的浓度(g/ml)。下方显示了使用NoRl和Tomocube 测得的数密度(平均值士标准差,NoRl:n=8,Tomocube:n=10)与生物量密度(平均值 士标准差,NoRI:n=15,Tomocube:n=约20)之间的相关性。右图展示了组织模拟中生物量密度的快照(平均值 ± 标准差,n=4次模拟)。b图显示,膜超极化程度随细胞密度的增加而升高,左图展示 MDCK-Voltron 细胞的荧光情况。下方为荧光强度对数变化量(平均值 士标准差,n=8)与数密度之间的对比。没错,这是组织模拟中膜电位快照的示例(平均值 士均方误差,n=4次模拟)。c-d,细胞密度与膜电位之间的相关性分析:(c)MCF10A和(d)EPH4-Ev细胞的情况。上侧面板:NoRI图像及定量结果(平均值 土 标准差,细胞密度数:n≈10,NoRl数:n=24)显示 MCF10AEpH4-Ev细胞在达到汇合状态后连续4天内的变化情况,细胞数量密度逐渐增加。下侧面板:Di0OC23)成像结果,显示从群落边缘到中心区域的分布情况。e.生物量生长与膜电位之间的反馈控制回路对于上皮组织的稳态至关重要。f-h,哇巴因引起的膜电位去极化作用会提高生物量密度(箱线图,线表示平均值,误差条表示最小值至最大值,n=40)以及汇合细胞的数量密度(n=8)相对于稳态稳定状态极限的水平(虚线表示稳态细胞数量和生物量的平均值;数据源自图a中所示的实验)。
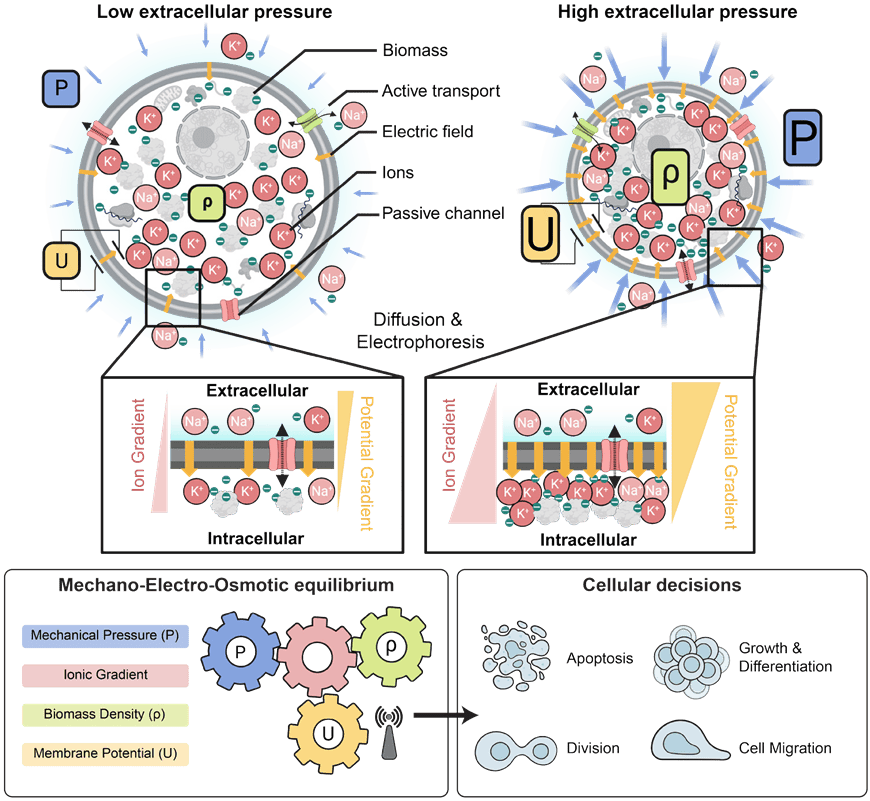
Box 1:机械-电-渗透模型。上图:该模型综合了三项基本守恒定律:跨质膜通量平衡、机械力平衡和电荷平衡。左侧图示的是处于较低机械压力下的细胞,右侧示的是相应的处于较高机械压力下的细胞。细胞内的生物量(如蛋白质和RNA)带有净负电荷。细胞通过胞质渗透压来抵抗体积压缩,这种渗透压能够抵消并平衡外部作用力(力平衡)。这种渗透压源自细胞内反离子的浓度分布,这些反离子被吸引以平衡带负电荷的大分子(电荷平衡)。正如右图所示,作用于细胞上的较高机械压力由此被更高浓度的反离子所平衡。细胞内离子浓度的升高会导致膜两侧离子浓度梯度变得更为陡峭,如图右附图所示。因此,在离子通道丰度保持不变的情况下,膜两侧更为陡峭的浓度梯度会导致离子扩散通量的增加(菲克定律)。当活性离子转运通量(钠-钾-ATP酶)保持不变时,这种增加的离子扩散通量会导致细胞质中净负电荷的积累,并相应地产生一个膜电位,该膜电位会抵消正电荷离子的扩散流出,直到通量平衡状态得以实现(每种离子类型的通量平衡)。下图:机械压力、细胞质生物量密度和膜电位之间的一一对应关系由图中所示的机械电渗透平衡呈现。
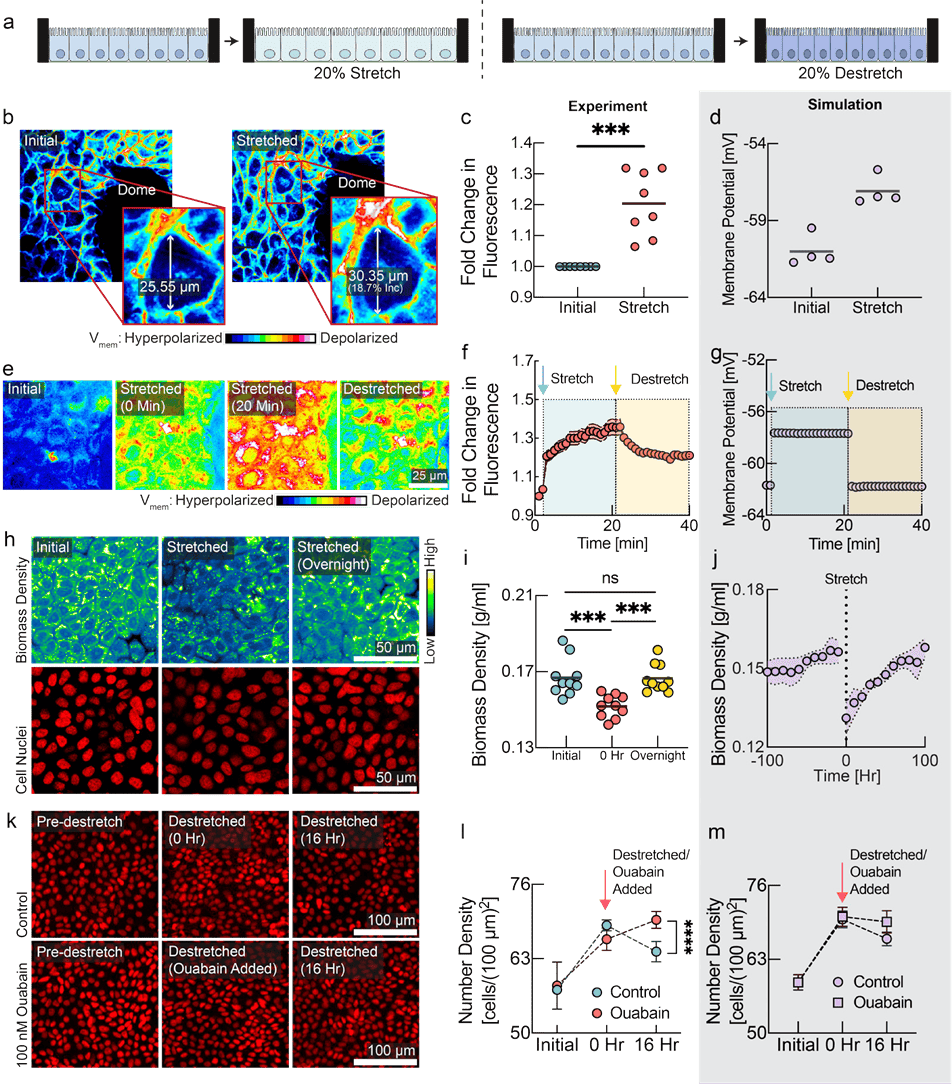
图 2:细胞通过膜电位的变化来感知并响应机械力。a,示意图展示了实验设计,其中单层细胞生长在可拉伸的膜上。左图:细胞生长至汇合状态后施加 20% 单轴拉伸。右图:细胞在预先拉伸的膜上生长至汇合状态后,拉伸被释放以诱导压缩。b,FluoVolt 图像显示MDCK细胞拉伸前后的情况。c,对b图的定量分析(线表示平均值,n=8,p=0.0006,配对t 检验)。d,组织模拟模型预测在 20% 单轴拉伸状态下膜电位的变化情况(以平均值表示,n=4次模拟)每个点均是对模拟中所有细胞进行平均得出的结果)。e,DiSBAC2(3)对MDCK细胞在拉伸前、拉伸过程中及拉伸后恢复原状时的成像,展示了膜电位变化的可逆性。f,对图e进行定量分析(平均值 士标准差,n=8)。荧光强度增加表示去极化,减少表示超极化。拉伸和恢复原状的时间分别用蓝色和黄色箭头表示。g,组织模拟模型预测的在拉伸及随后恢复原状时膜电位的变化情况(n=4次模拟,每个点均为对所有细胞进行平均得出的结果)。h,NORI图像显示细胞生物量对组织拉伸的反应。生物量密度在一夜之间恢复至初始生物量密度水平。i,对图h的定量分析。0小时代表拉伸时间。(n=10,p值:0.0006(初始vs0小时)、0.0001(0小时vs一夜之间),配对t检验)。j,组织模拟再现了生物量密度在拉伸后下降以及一夜恢复的情况。(平均值 土均方误差,n=4次模拟)k,Ouabain 能够缓解因解拉伸引起的组织拥挤现象。经过 16小时,大量细胞已被清除,这与先前研究的结果一致。l,面板K的定量分析(平均值 ±标准误差,n=3次实验,每项实验包含20个 ROI,p值<0.0001,未配对t检验)。m、组织拟再现了细胞在受压后消失以及随后通过去极化药物干预而得以挽救的过程(平均值 士标准误差,n=4次模拟)。
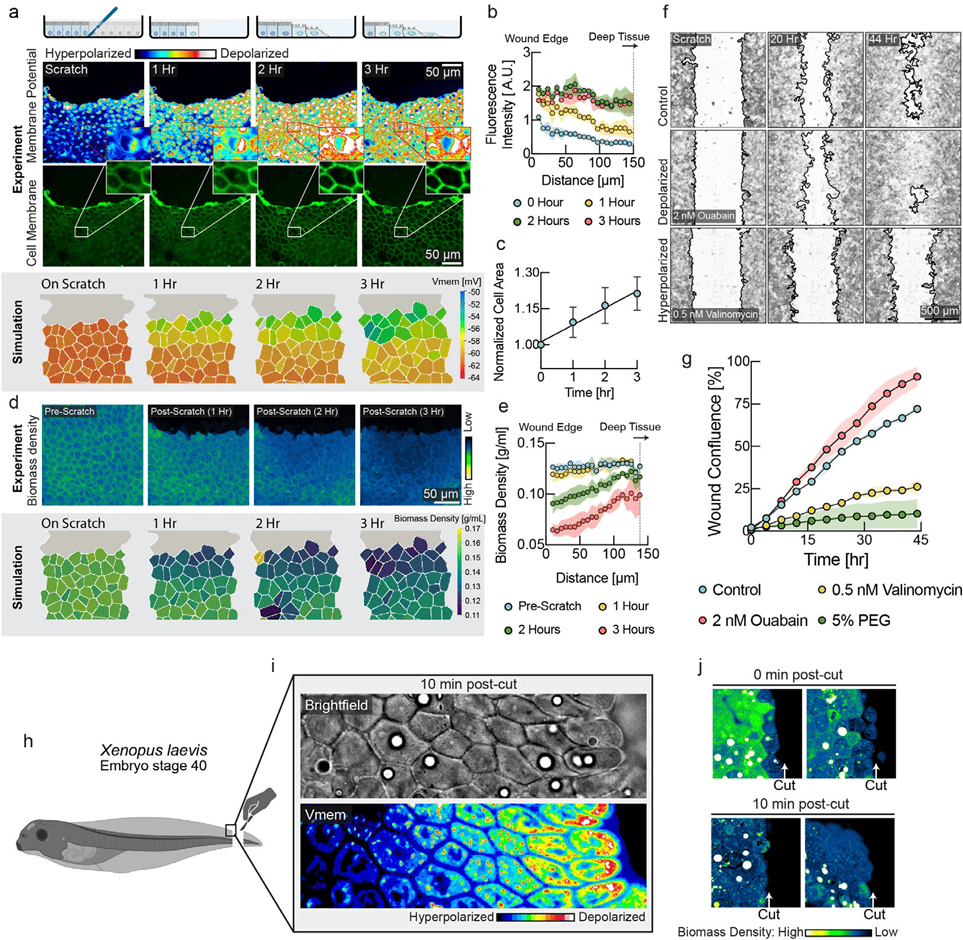
图3:机械诱导的去极化波有助于促进伤口愈合。a,上栏:DiSBAC2(3)及荧光标记的MDCK细胞膜图像,拍摄时间为划痕伤口形成后3小时。可见从伤口边缘开始,去极化波向上延伸至数层深处,深入组织内部。下栏:模拟组织在伤口愈合过程中膜电位的变化情况。b,膜电位随距离划痕伤口远近变化的定量分析结果(平均值 土标准差,n=4个宽度为 100um的矩形ROI)。c,细胞面积的定量分析显示,在伤口愈合过程中细胞面积有所扩张(平均值 土标准差,n=9)。d图示:上图为伤口愈合过程中 NoRI成像结果;下图为组织模拟模型中随伤口愈合过程变化的生物量密度。e图示:细胞生物量密度的定量分析结果,以距离创口不同时间点的距离为参数进行展示(平均值 士标准差)s.d.,n=4矩形 ROI,宽度为50um)。f,对照组、去极化药物处理(ouabain)和极化药物处理(valinomycin)在伤口愈合过程中的代表性图像。伤口边缘轮是利用“伤口愈合尺寸工具”生成的。g,对伤口面积闭合情况进行时间依赖性定量分析(平均值士s.d.,n=2孔)。去极化处理(ouabain,红色圆圈)相较于未处理的对照组(cyancircles,蓝色圆圈)可加速伤口愈合。极化处理(valinomycin,yellowcircles,5%PEG,green circles)则导致伤口愈合速度减慢。h.展示爪蟾胚胎尾部截断实验装置示意图。i.爪蟾伤口边缘的明场图像和膜电位(DiSBAC2(3))图像,截断后10分钟时。细胞层从深层组织逐渐向伤口边缘发生去极化。i.爪蟾尾部截断后的 NoRI图像,截断后0分钟和 10 分钟时的情况。截断后即刻,最接近细胞层的生物量密度会显著降低,而5到6层细胞会在 10分钟内出现生物量密度降低的现象。这些图像展示了在不同指定时间点截断并固定后的不同爪蟾胚胎情况。
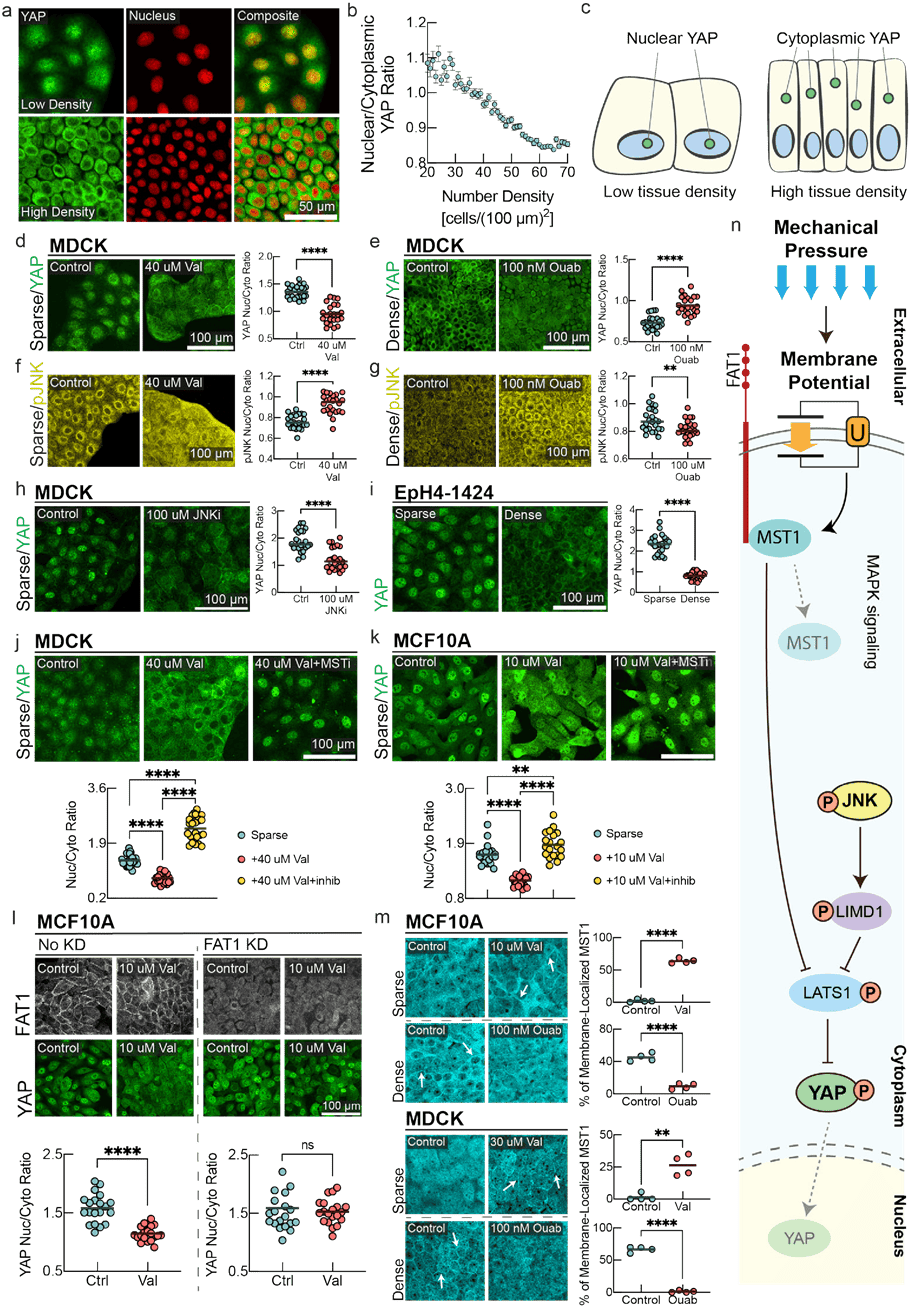
图 4:河马和 MAPK通路介导膜电位信号传递。a,YAP免疫染色及荧光核图像,显示低密度(上栏)和高密度 MDCK单层细胞的情况(下栏)。b,YAP核/胞质比例随细胞数密度变化的定量分析结果(平均值 土均方误差,n=20337,细胞按局部数密度合并归类)。c,YAP 在不同细胞数密度下定位的示意图。d-g,在稀疏(左栏)和密集(右栏)条件下对MDCK细胞进行YAP和磷酸化JNK(pJNK)的免疫染色,并对应进行了药物干预。d-e,测量 YAP 的核/胞质比例。d,在稀疏细胞中,YAP 定位在细胞核内,而诱导超极化现象则显著促进了 YAP 的核外排。e.在密集融合细胞中,与对照组相比,由欧宝因(ouabain)引起的去极化作用会抑制 YAP 的核外排。在图中,线代表平均值,n=24,且p值是通过配对t检验测得的,结果小于0.0001(除非另有说明)。f.在稀疏的MDCK细胞中,pJNK主要定位于细胞质内。而通过瓦里诺霉素(valinomycin)诱导超极化则会促进pJNK向细胞核的进一步定位。g.在密集且融合程度较高的细胞中,乌苯胺导致的去极化作用相较于对照组促进了 pJNK的核外排。h.JNK抑制剂显著促进了 YAP 在稀疏 MDCK细胞中的核外排。i.在Eph4-1424 细胞中,YAP 的核定位遵循 YAP 核质穿梭的经典密度依赖性规律。j-k.对稀疏MDCK/MCF10A细胞进行YAP免疫染色,分别与对照组、瓦里诺霉素处理以及瓦里诺霉素联合 MST抑制剂(XMU-MP-1)处理条件下的结果进行比较。稀疏与瓦里诺素+MSTi处理条件下的p值为 0.0092。l,带有或未带有 FATI敲低(KD)效果的稀疏 MCF10A细胞在对照及瓦立诺霉素条件下被染色以检测 FATI和 YAP 的表达情况。对照状态下 FATIKD 细胞与瓦立诺霉素处理条件下的细胞核/细胞质比例间的p值为0.558(ns)。l,对 MCF10A/MDCK 细胞在稀疏对照、稀疏瓦立诺霉素、密集对照及密集偶联素条件下进行 MST1免疫染色。白色箭头标出 MST1组织化膜簇增多的区域。m,对于各图中的定量分析,对随机视野中单个细胞内的 MST1定位进行了分析。该线处于均值,n=4ROI,p值是用未配对的t检验测量的。MDCK稀疏对照v.缬氨酸霉素的p值为0.0012,其他地块的p值为<0.0001。n,总结膜电位介导的信号转导机制示意图。膜电位的去极化激活细胞质pJNK,从而激活LIMD1以抑制LATS1,导致 YAP 易位到细胞核。同时,膜电位的超极化导致MST1与FAT1的c端尾部共定位,组装 Hippo 信号组。这种河马“开启”状态会阻止核转位过程
研究意义与影响
- 提供了机械转导的新范式:不同于传统的钙信号或细胞骨架张力机制,膜电位提供了一种全局、快速、与细胞形状和大小无关的机械感知机制。
- 解释了Hippo通路的上游信号:首次提出膜电位可能通过调控FAT1-MST1复合体组装来激活Hippo通路。
- 在再生医学与癌症研究中有潜在应用:
- 调节膜电位可能成为促进伤口愈合的新策略。
- 肿瘤细胞常表现出膜电位去极化,可能导致其丧失对机械压力的正常响应,促进不受控生长。
- 进化意义:膜电位作为机械感知机制可能在早期多细胞生物中就已存在,是一种古老而保守的调控机制。
提供细胞机械刺激培养系统:包括细胞牵张拉伸、静水压、剪切、电刺激仪器;向有意向客户提供试用服务。
提供Piuma系列生物纳米压痕仪:可测量细胞、组织、软骨、水凝胶、类器官、高分子材料等生物软物质力学性能参数:杨氏模量(5pa~1Gpa)、粘弹性(松弛、蠕变、储能、损耗)等,向有意向客户提供试样服务。
提供生物材料微小力学测试仪器:可测量细胞球、水凝胶球、鱼卵、蛛丝、微针、巩膜、角膜、基质透镜、瓣膜、血管、组织工程支架、肌腱、皮肤、薄膜等生物材料的拉伸、压缩、弯曲、剪切等力学性能。向有意向客户提供试样服务。
